Thành phần cấu tạo và nguyên lý hoạt động của pin lithium-ion NCM: hình ảnh trực quan
Phạm vi bài viết
Năm 2019, lithium ion đã chiến thắng giải Nobel hóa học và ngày nay đã trở thành ứng dụng phổ biến len lỏi tới từng ngóc ngách trong đời sống của chúng ta, từ điện thoại di động, máy tính bảng tới xe cộ, các thiết bị lưu trữ năng lượng.
Trong bài viết này chúng tôi phân tích thành phần hóa học, các bộ phận cấu tạo nên loại pin lithium ion phổ biến nhất trên thị trường Việt Nam hiện nay là pin NCM (Niken Mangan Cobalt) 3.7V. Loại pin sạc này thường thấy trong pin tiêu dùng như pin lithium ion cho xe đạp điện, pin lithium xe điện EV, pin laptop, ipad, máy bay không người lái, camera và nhiều ứng dụng khác.
Xem thêm: Các loại pin lithium ion
Cấu tạo pin lithium-ion – hình ảnh trực quan
Giống như các loại pin khác, Pin lithium-ion được cấu thành bởi hai điện cực cathode và anode, chất điện phân và màng phân tách.
Xem thêm: Thành phần cấu tạo của pin

Cấu tạo pin lithium-ion. Nguồn Energy X website
Thành phần hóa học pin lithium-ion NCM
Pin Lithium-ion có nhiều công thức hóa học khác nhau, loại thường thấy nhất là NMC (Niken, mangan và cobalt) ở Châu Âu và Bắc Mỹ, kế đến là pin sắt phốt phát LFP (LiFePO4). Loại đầu có năng lượng riêng cao, loại sau có giá thành rẻ hơn.
Dưới đây là thành phần cấu tạo hóa học trung bình của một pin lithium-ion:
| Vật liệu | Tỷ lệ % |
| Nickel (Ni) | 4% |
| Manganese (Mn) | 5% |
| Lithium (Li) | 7% |
| Cobalt (Co) | 7% |
| Đồng (Cu) | 10% |
| Nhôm (Al) | 15% |
| Than chì Graphite (C) | 16% |
| Các chất khác | 36% |
Tính trugn bình, 1g lithium được quy đổi tương đương ra 5.17g lithium các bon nát.
Nguyên lý hoạt động của pin lithium ion
Dòng chuyển dời có hướng của ion trong pin lithium-ion khi sạc (charge) và khi xả (discharge).
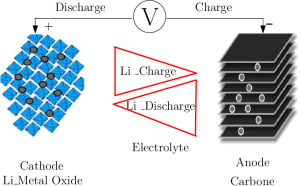
Nguồn: Dòng chuyển dời có hướng của ion lithium trong pin lithium ion – Báo cáo đã công bố từ ResearchGate
Khi pin xả và cấp một dòng điện, các ion lithium tích trong anode sẽ chạy sang cathode, tạo ra một dòng electron chạy theo hướng ngược lại.
Khi cắm sạc, lithium ion sẽ được cathode nhả ra và anode sẽ nhận lại. Dòng electron chạy theo hướng ngược lại.
Khi xả, anode trải qua quá trình ô-xy hóa hay còn gọi là mất electrons, và cathode xảy ra phản ứng khử (hay sự nhận electrons). Khi ion di chuyển từ cực này sang cực kia của pin, chúng tạo ra luồng electron chính là nguồn điện mà pin có thể cấp. Vì vòng di chuyển này lặp đi lặp lại nhiều lần nên người ta gọi đây là pin sạc nhiều lần (Rechargable battery).
Pin lithium-ion cấp điện dựa trên cơ chế dòng chuyển dời có hướng của các ion. Lithium kim loại là chất phản ứng rất mạnh, nên trong pin người ta thường dùng ô xít lithium thay vì dạng kim loại nguyên chất. Ô xít này sẽ dùng làm cathode và đóng vai trò cấp ion lithi, còn hợp chất lithi các-bon sẽ dùng làm anode. Cả hai điện cực đều là các chất cho phép thẩm thấu ion lithi vào cấu trúc phân tử một cách dễ dàng.
Các phản ứng hóa học xảy ra trong pin lithium-ion
Bên trong pin lithium ion xảy ra phản ứng ô-xy hóa khử.
Phản ứng khử: xảy ra ở cathode: cobalt ô xít phản ứng với ion li+ để tạo thành lithium cobalt oxide (LiCoO2).
CoO2 + Li+ + e– → LiCoO2
Phản ứng ô xy hóa xảy ra ở anode. Hợp chất LiC6 tạo thành graphite (C6) và ion li+
LiC6 → C6 + Li+ + e–
Tổng cộng phản ứng ô xy hóa khử đầy đủ trong pin (từ trái sang phải = xả, từ phải sang trái = sạc)
LiC6 + CoO2 ⇄ C6 + LiCoO2


 English
English
